Adakveo vs Oxbryta: crizanlizumab alternatiflerinizi tanıyın
Son güncelleme: 15 Ocak 2024
Ülkenizde onaylanmamış olsalar bile yeni ilaçlara yasal olarak erişebilirsiniz.
Nasıl olduğunu öğrenin
Adakveo (crizanlizumab)'un AB'deki izninin iptal edilmesinin ardından, birçok hasta ve doktorun Adakveo alternatifi bulması gerekiyor.
Tedavinize iyi yanıt verdiyseniz, artık AB'de onaylanmamış olsa bile Adakveo adresine erişebilirsiniz. Bununla birlikte, doktorunuz tedavi sürecinizi değiştirmeyi tercih ederse, bunun bir hasta olarak sizin için ne anlama geldiğini anlamanız iyi olacaktır.
Bu makalede doktorunuzun görüşmek isteyebileceği olası Adakveo alternatiflerinden birine bakacağız - Oxbryta (voxelotor). Burada Adakveo ve Oxbryta arasındaki benzerlik ve farklılıklara hızlı bir genel bakış bulacaksınız.
Adakveo vs Oxbryta: Ne için kullanılırlar?
Hem Adakveo hem de Oxbryta orak hücre hastalığının tedavisi için endike reçeteli ilaçlardır 1,2. Ancak ilaçların her biri hastalığın farklı bir yönünü hedeflemektedir.
Adakveo ağrılı vazo tıkayıcı krizlerin sıklığını azaltmayı amaçlarken, Oxbryta orak hücre hastalarında hemolitik anemiyi tedavi etmek için kullanılmaktadır 1,2.
Oxbryta AB'de kaç yaş için onaylanmıştır?
Sadece 16 yaş ve üzeri hastalarda kullanılabilen Adakveo'un aksine, Oxbryta pediatrik hastalar için de endikedir.
ABD'de Oxbryta 4 yaşından itibaren reçete edilebilirken, AB'de pediatrik kullanım sadece 12 yaşından itibaren onaylanmıştır 1,2.
Crizanlizumab vs Voxelotor: Nasıl çalışırlar?
Her iki ilaç da orak hücre hastalığının komplikasyonlarını azaltmayı amaçlasa da, hastalığın farklı yönlerini hedef alırlar.
Adakveo ve acı veren krizlerin azaltılması
Adakveo hatalı biçimlenmiş kan hücrelerinin kan damarlarında sıkışmasıyla ortaya çıkan ağrılı krizlerin sıklığını azaltmayı amaçlamaktadır.
İlacın aktif bileşeni olan crizanlizumab, monoklonal antikor olarak bilinen spesifik bir protein türüdür. Bu protein, kan damarlarını kaplayan hücrelerin dış tabakasında bulunan bir madde olan P-selektine bağlanmak üzere formüle edilmiştir.
P-selektin, hücrelerin kan damarlarına yapışmasına yardımcı olur ve orak hücre hastalığındaki ağrılı ataklar sırasında damar tıkanıklıklarında rol oynar. Adakveo , P-selektine bağlanarak ve işlevini engelleyerek bu ağrılı atakları önlemeyi amaçlamaktadır 3.
Oxbryta ve aneminin önlenmesi
OxbrytaÖte yandan, orak hücre hastalığına bağlı anemiyi önlemeyi amaçlamaktadır.
Oxbryta, voxelotor adresindeki aktif bileşen, hemoglobinin oksijen tutma kapasitesini artırır ve kan damarları içinde sert zincirler oluşturmasını engeller. Bu, kırmızı kan hücrelerinin normal şekillerini ve esnekliklerini korumalarına yardımcı olur. Ayrıca erken yıkım oranlarını azaltır ve ömürlerini uzatır4.
Adakveo ve Oxbryta ne kadar verimlidir?
Adakveo (crizanlizumab) ve Oxbryta (voxelotor) adreslerinin etkinliği klinik çalışmalarda incelenmiştir.
-
Adakveo kli̇ni̇k araştirma sonuçlari
Adakveo'nin FDA onayı ve AB'deki ilk pazarlama izni SUSTAIN klinik çalışmasının sonuçlarına dayanıyordu. Çalışmada Adakveo (hidoksiüre ile veya hidoksiüre olmadan) plasebo ile karşılaştırılmıştır.
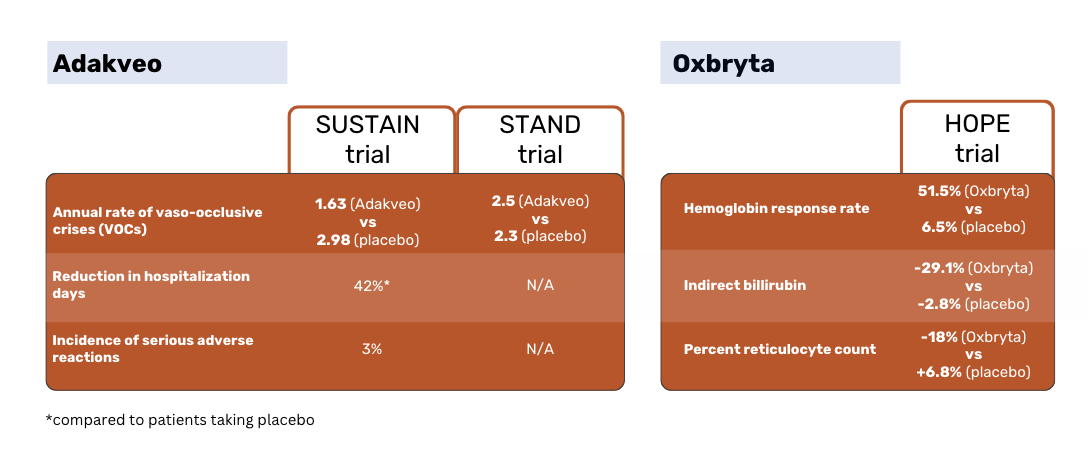
SUSTAIN çalışma sonuçlarına göre, Adakveo ile tedavi edilen hastalarda yıllık medyan vazo-oklüzif kriz (VOC) oranı istatistiksel olarak anlamlı bir şekilde daha düşüktür - plasebo hastalarında 1,63'e karşılık 2,98. Denemedeki Adakveo hastalarının %36'sında 52 haftalık deneme süresi boyunca VOC görülmezken, plasebo hastalarının %17'sinde görülmüştür1.
Adakveo STAND denemesinin sonuçları ne oldu?
Yine Adakveo ile plaseboyu karşılaştıran global faz 3 STAND çalışması, hasta grupları arasında VOC oranında istatistiksel olarak anlamlı bir fark gösterememiştir. Adakveo ile tedavi edilen hastalarda tedaviden sonraki bir yıl içinde ortalama 2,5 ağrılı kriz görülmüştür - bu oran plasebo grubunda bildirilen ortalama 2,3 krizden anlamlı derecede farklı değildir3.
STAND davasının ikna edici olmayan sonuçları Adakveo'un AB'de iptal edilmesinin temelini oluşturdu.
-
Oxbryta kli̇ni̇k araştirma sonuçlari
HOPE çalışmasında, Oxbryta plaseboya karşı test edilmiştir. Etkililik, başlangıçtan 24. Haftaya kadar >1 g/dL Hb artışı olarak tanımlanan hemoglobin (Hb) yanıt oranlarına dayanmaktadır.
Oxbryta hastalarda yanıt oranı %51,1 iken plasebo hastalarında %6,5 olmuştur. İndirekt bilirubin Oxbryta hastalarında %29,1 oranında azalırken, plasebo hastalarında %2,8 oranında azalmıştır. Yüzde retikülosit sayısı Oxbryta hastalarında %18 oranında azalırken plasebo hastalarında %6,8 oranında artmıştır2.
Paylaşılan verilerin gösterdiği gibi, klinik çalışmalarında farklı etkinlik kriterleri kullanıldığından, iki ilaç arasında doğrudan bir karşılaştırma yapmak mümkün değildir. Her iki tedavi de orak hücre hastalığına farklı bir şekilde yaklaştığından, Oxbryta 'un Adakveo'un doğrudan yerini alması değil, doktorunuzun sizin için oluşturacağı yeni bir tedavi planının bir parçası olması muhtemeldir.

Adakveo vs Oxbryta: Güvenlik ve yan etkiler
Reçete bilgilerine göre, bunlar Adakveo ve Oxbryta'un en yaygın yan etkileridir:
Adakveo yan etkiler
- Mide bulantısı
- Eklem ağrısı
- Sırt ağrısı
- Mide ağrısı
- Ateş1.
SUSTAIN çalışması sırasında hastaların %3'ünde baş ağrısı, titreme, kusma, ishal, nefes darlığı veya hırıltılı solunum gibi semptomlarla karakterize edilen infüzyonla ilişkili reaksiyonlar görülmüştür1.
Oxbryta yan etkiler
- Baş ağrısı
- Ishal
- Mide ağrısı
- Mide bulantısı
- Döküntü
- Fever 2.
Klinik çalışma hastalarının %1'inden daha azında döküntü, hafif nefes darlığı, hafif yüz şişmesi ve eozinofili (beyaz kan hücrelerinin sayısında artış)2 gibi ciddi aşırı duyarlılık reaksiyonları görülmüştür.
Adakveo vs Oxbryta: Fiyat karşılaştırması
Henüz onaylanmamış veya mevcut olmayan ilaçların fiyatları söz konusu olduğunda, bunları yalnızca gösterge olarak kabul etmelisiniz. Nihai fiyat, bulunduğunuz yere veya tedarikçiye bağlı olarak değişebilir.
Adakveo yıllık maliyetler
Adakveo için önerilen dozaj her 4 haftada bir 5 mg/kg vücut kütlesidir. Bu da yılda 13 infüzyon anlamına gelmektedir. Bu, 60 kg ağırlığındaki bir kişi için 13 infüzyon x 300 mg Adakveo veya 39 flakon ilaç gerektirir.
Her 100 mg'lık flakon için yaklaşık 5.214 Avro'luk bir fiyatla, Adakveo tedavisinin yıllık maliyeti yaklaşık 203.346 Avro'ya ulaşmaktadır5.
Oxbryta yıllık maliyetler
Vücut ağırlığı 40 kg'ın üzerinde olan hastalar için önerilen Oxbryta dozu, her biri 3 tablet x 500 mg'a eşit olacak şekilde günde bir kez 1.500 mg Oxbryta 'dur.
90 x 500 mg tabletten oluşan bir paketin maliyeti yaklaşık 40.365 Avro'dur ve yukarıda önerilen dozaj temel alındığında bir ay için yeterlidir. Dolayısıyla Oxbryta tedavisinin yıllık maliyeti 484.380 Avro'ya ulaşmaktadır6.
Adakveo ve Oxbryta nerede onaylanmıştır?
Adakveo (crizanlizumab) şu anda ABD, Kanada ve Avustralya dahil olmak üzere birçok ülkede onaylanmıştır 7,9,10. AB'deki şartlı pazarlama izni Mayıs 2023'te iptal edilmiştir 3.
Oxbryta (voxelotor) ABD, AB ve Kanada'da onaylanmıştır 4,8,9. Bununla birlikte, AB içinde, ruhsatlandırma ve piyasaya sürme arasındaki süre ülkeden ülkeye önemli ölçüde değişebildiğinden, Oxbryta henüz piyasada yaygın olarak mevcut değildir.
Adakveo veya Oxbryta ülkenizde (artık) onaylanmadı mı veya mevcut değil mi? Siz ve doktorunuz bu tedavilerin size fayda sağlayabileceğini düşünüyorsanız, İlaca Erişim uzmanları ekibimizle iletişime geçin. Sizin için ilacı tedarik etmek üzere size kişiselleştirilmiş bir fiyat teklifi verebiliriz.
Başvuru:
- REÇETELEME BILGILERININ ÖNEMLI NOKTALARI. Novartis, Erişim tarihi: 27 Eylül 2023.
- REÇETELEME BILGILERININ ÖNEMLI NOKTALARI. Oxbryta, Erişim tarihi 27 Eylül 2023.
- Adakveo | Avrupa İlaç Ajansı. Avrupa İlaç Ajansı, Erişim tarihi: 27 Eylül 2023.
- Oxbryta | Avrupa İlaç Ajansı. Avrupa İlaç Ajansı, Erişim tarihi: 27 Eylül 2023.
- Adakveo ( crizanlizumab)Online Satın Alın. Everyone.org, Erişim tarihi 27 Eylül 2023.
- Oxbryta ( voxelotor)Online Satın Alın. Everyone.org, Erişim tarihi 27 Eylül 2023.
- Adakveo. Therapeutic Goods Administration (TGA), Erişim tarihi: 27 Eylül 2023.
- FDA, pediatrik hastalarda orak hücre hastalığını tedavi eden ilacı onayladı. FDA, 17 Aralık 2021.
- 2019'da Onaylanan Yeni İlaçlar - Meds Entry Watch. Canada.ca, 10 Şubat 2021.
- FDA, orak hücre hastalığının ağrılı komplikasyonu olan hastaları tedavi etmek için ilk hedefe yönelik tedaviyi onayladı. FDA, 15 Kasım 2019.