Enhertu Yumurtalık Kanserini Tedavi Edebilir mi? Tüm Veriler, Hiçbiri Abartı Değil.
Son Güncelleme 15 Temmuz 2024
Ülkenizde onaylanmamış olsalar bile yeni ilaçlara yasal olarak erişebilirsiniz.
Nasıl olduğunu öğreninEnhertu ( fam-trastuzumab deruxtecan-nxki ) ilk olarak 2019 yılında FDA tarafından onaylandı 1 . O noktada, HER2 pozitif meme kanserinin tedavisi için endikeydi. O zamandan beri, Enhertu daha fazla endikasyon için onaylanmıştır. Bunlara HER2 pozitif mide kanseri, HER2 düşük meme kanseri ve HER2 mutant küçük hücreli olmayan akciğer kanseri dahildir. Nisan 2024'ten bu yana tedavi, tüm HER2 pozitif tümörlerde kullanım için FDA tarafından da onaylanmıştır 5 .
Bu bağlamda, Enhertu medyanın ilgisini çekti. Bu abartının doğal bir sonucu olarak, her yerdeki kanser hastaları merak ediyor Enhertu onlar için de geçerli olabilir.
Her zamanki gibi, gürültüyü kesmek ve mevcut verilere bakmak için buradayız. Bu makalede, bilmeniz gereken her şeyi gözden geçireceğiz Enhertu Yumurtalık kanseri için.
Hangi kanser türü? Enhertu davranmak?
Her yerdeki hastalar merak ediyorlardı Enhertu tüm kanserleri tedavi edebilir. Ne yazık ki durum böyle değil. Ve tasarımsal olarak da böyle değil. Enhertu özellikle şunlara yönelik hedefli bir terapidir:
- HER-2 ekspresyonuna sahip tümörler . HER-2, vücuttaki farklı hücre tiplerinin yüzeyinde bulunan bir proteindir. Normal hücre büyümesine yardımcı olur. Ancak bazı kanserlerde gen değişiklikleri veya mutasyonlar nedeniyle aşırı aktif hale gelebilir. HER2 aşırı ekspresyonu yumurtalık kanseri vakalarının %2 ila %66'sını etkiler 5 .
- Vücudun diğer bölgelerine yayılmış ve/veya ameliyat edilemeyen tümörler 4. Gelecekteki klinik çalışmalar şunları içerebilir: Enhertu kanser tedavisinin erken evrelerinde 6. Ancak, şu anda durum böyle değil.
Ne kadar etkili? Enhertu Yumurtalık kanseri için mi?
Devam eden 2. faz DESTINY-PanTumor02 denemesi testlere odaklanıyor Enhertu 'nin çeşitli HER2 pozitif solid kanserlerdeki aktivitesi. Bunlardan biri de yumurtalık kanseridir. Denemenin ara sonuçları Haziran 2023'te paylaşıldı ve biraz umut vadediyor.
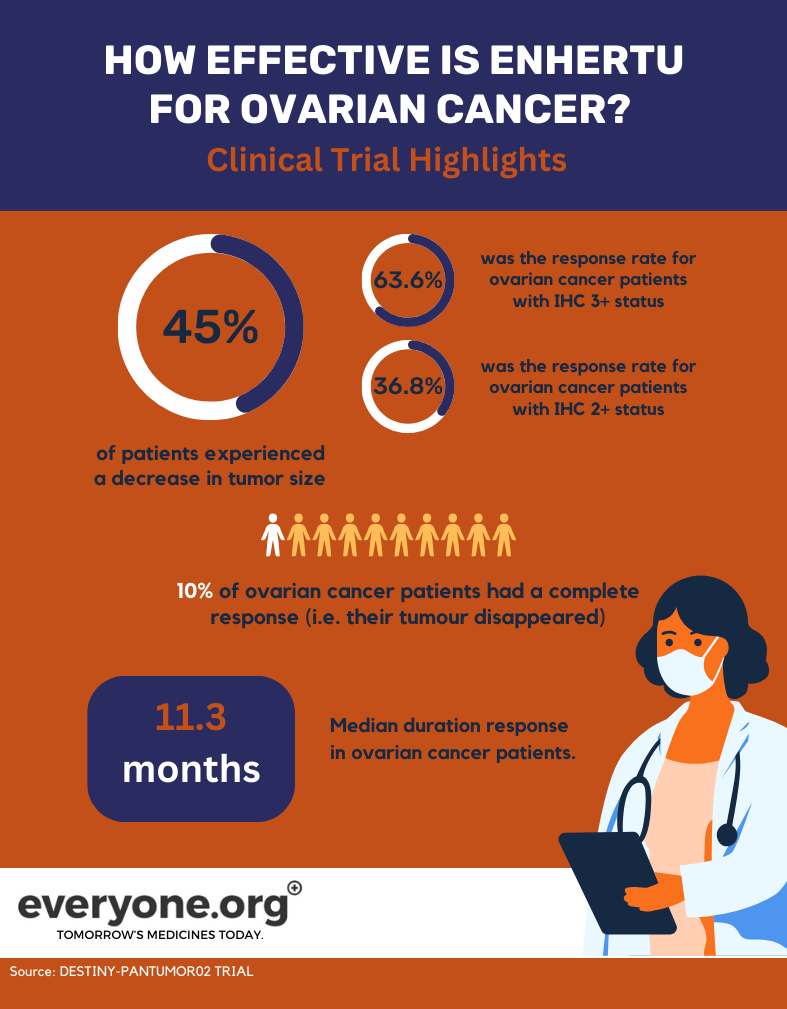
Yumurtalık kanseri hastaları için, çalışmanın temel ön sonuçları şunlardır:
- Genel yanıt oranı %45,0 idi. Bu, tedavi edilen hastaların %45'inin Enhertu tümörlerinin küçülmesini sağladı. HER2 durumu IHC 3+ olan hastalar için genel yanıt oranı %63,6 idi. IHC 2+ durumu olanlar için yanıt oranı %36,8 idi 3 .
- Yumurtalık kanseri hastalarının %10'unda tam yanıt vardı. Başka bir deyişle, tümörleri tamamen ortadan kalktı 3 .
- 12 ay sonra, tümörleri küçülen veya kaybolan over kanseri hastalarının %45,8'i hala bu faydayı yaşadıklarını bildirdi 3 .
- Yumurtalık kanseri hastalarında yanıtın ortanca süresi 11,3 ay idi 3 .
Genel olarak, bu sonuçlar cesaret verici olarak değerlendirilebilir. Dr. Meric-Bernstam'a (ABD MD Anderson Kanser Merkezi'nde Araştırmacı Kanser Tedavileri Bölümü Başkanı) göre yanıtların uzun sürmesi özellikle dikkat çekici bir sonuçtur 3 .
Bu klinik çalışma sonuçlarına dayanarak, ABD'deki FDA, Enhertu HER2 ekspresyonuna sahip tüm kanserlerde kullanılabilecek bir ilacın ilk kez onaylanması.

Ne zaman olacak? Enhertu Yumurtalık kanseri için onay alınır mı?
Nisan 2024 itibariyle, Enhertu Yumurtalık kanseri de dahil olmak üzere HER2 ekspresyonu olan tüm kanserler için onaylanmıştır.
DESTINY-PanTumor02 denemesi devam ediyor ve nihai sonuçların 2027 Nisan ayında açıklanması bekleniyor 7 . Ancak, çalışmanın ön sonuçları FDA'nın yakın zamanda verdiği pan-tümör onayı için yeterliydi.
ABD dışında yaşıyorsanız, Enhertu 'nin yumurtalık kanseri için onay durumu farklı olabilir.
Doktorum reçete yazabilir mi? Enhertu Yumurtalık kanseri için mi?
Şu anda en iyi cevap, belki.
Temmuz 2024 itibariyle, Enhertu HER2 pozitif over kanserinin tedavisi için yalnızca ABD'de onaylanmıştır. Ancak, diğer ülkelerde bile, doktorunuz bu endikasyon için ilacı reçete etme yetkisine sahiptir. Bunu, DESTINY-PanTumor02 klinik çalışmasının ön sonuçlarına ve vakanızın özelliklerine dayanarak yapabilirler.
Bir doktor, henüz yerel olarak onaylanmamış bir hastalığı tedavi etmek için bir ilaç yazdığında, buna etiket dışı kullanım denir. Etiket dışı kullanım reçetesi, yerel düzenlemelere ve bulunabilirliğe bağlı olarak bazı ülkelerde doldurulması zor olabilir. Ancak, Adlandırılmış Hasta İthalatı düzenlemesini kullanarak doldurmak her zaman mümkündür.
Doktorunuz reçete yazma kararı aldı mı? Enhertu Yumurtalık kanserinizin tedavisi için mi? www. adresindeki ekibimiz. everyone.org ilaca erişmenize yardımcı olabiliriz. Bir hastanın ülkesinde onaylanmamış veya bulunmayan reçeteli ilaçların temini ve teslimatı konusunda uzmanlaştık. Bizimle iletişime geçin, size yardımcı olabilelim.
Referanslar:
- Stewart, Judith. Enhertu ( fam-trastuzumab deruxtecan-nxki ) FDA Onay Geçmişi . Drugs.com, 15 Ağustos 2022.
- Çığır Açan Terapi . FDA, 4 Ocak 2018.
- Doherty, Kyle. Enhertu Tedavisi Zor Katı Kanserler İçin Umut Vaat Ediyor . Cure Today, 6 Haziran 2023.
- USPI-DB-04 CDX Güncellemesi SON . Daiichi Sankyo , 3 Ekim 2023'te erişildi.
- Teplinsky, Eleonora ve Franco Muggia. EGFR ve HER2: Yumurtalık kanserinde bir rolü var mı?, Translational Cancer Research, 13 Şubat 2015.
- Liu, Angus. ASCO: Enhertu 'çok ikna edici' pan-tümör aktivitesi sunuyor . Fierce Pharma, 5 Haziran 2023.
- Seçilmiş HER2 Ekspresyonlu Tümörlü Hastalarda T-DXd'nin 2. Faz Çalışması (DPT02) , ClinicalTrials.gov, Erişim tarihi 03 Ekim 2023.