Adakveo vs Oxbryta: crizanlizumab alternatiflerinizi tanıyın
Son güncelleme: 15 Ocak 2024
Ülkenizde onaylanmamış olsalar bile yeni ilaçlara yasal olarak erişebilirsiniz.
Nasıl olduğunu öğrenin
Takip etme Adakveo ( crizanlizumab )'in AB'deki yetkisi iptal edildiğinden, birçok hasta ve doktorun bir çözüm bulması gerekiyor Adakveo alternatif.
Tedavinize iyi yanıt verdiyseniz, yine de erişebilirsiniz Adakveo AB'de artık onaylanmamış olsa bile. Ancak, doktorunuz tedavi sürecinizi değiştirmeyi tercih ederse, bunun bir hasta olarak sizin için ne anlama geldiğini anlamak iyi olur.
Bu yazıda olası seçeneklerden birine bakacağız Adakveo Doktorunuzun tartışmak isteyebileceği alternatifler - Oxbryta ( voxelotor ). Burada, benzerlikler ve farklılıklar hakkında kısa bir genel bakış bulacaksınız. Adakveo Ve Oxbryta .
Adakveo Karşı Oxbryta : Bunlar ne için kullanılır?
İkisi birden Adakveo Ve Oxbryta reçeteli ilaçlar orak hücre hastalığının tedavisi için endikedir 1,2 . Ancak ilaçların her biri hastalığın farklı bir yönünü hedef alır.
Adakveo ağrılı vazo oklüzif krizlerin sıklığını azaltmayı hedeflerken, Oxbryta Orak hücreli anemi hastalarında hemolitik anemiyi tedavi etmek için kullanılır 1,2 .
Kaç yaşındasın? Oxbryta AB'de onaylandı mı?
Farklı Adakveo 16 yaş ve üzeri hastalarda kullanılabilen, Oxbryta Pediatrik hastalarda da endikedir.
ABD'de, Oxbryta 4 yaşından itibaren reçete edilebilirken, AB'de pediatrik kullanımı ancak 12 yaşından itibaren onaylanmaktadır 1,2 .
Crizanlizumab Karşı Voxelotor : Nasıl çalışırlar?
Her iki ilaç da orak hücreli anemi hastalığının komplikasyonlarını azaltmayı amaçlasa da hastalığın farklı yönlerini hedef alıyorlar.
Adakveo ve acı verici krizlerin azaltılması
Adakveo Kötü şekilli kan hücrelerinin kan damarlarında sıkışmasıyla oluşan ağrılı krizlerin sıklığını azaltmayı hedefliyor.
İlacın etken maddesi, crizanlizumab , monoklonal antikor olarak bilinen belirli bir protein türüdür. Bu protein, kan damarlarını kaplayan hücrelerin dış tabakasında bulunan bir madde olan P-selectine bağlanmak üzere formüle edilmiştir.
P-selectin hücrelerin kan damarlarına yapışmasına yardımcı olur ve orak hücre hastalığındaki ağrılı bölümler sırasında damar tıkanıklıklarında rol oynar. P-selectine bağlanarak ve işlevini engelleyerek, Adakveo Bu ağrılı dönemlerin önlenmesini amaçlar 3 .
Oxbryta ve kansızlığın önlenmesi
Oxbryta Öte yandan orak hücreli anemi hastalığına bağlı kansızlığın önlenmesi amaçlanıyor.
Etkin madde: Oxbryta , voxelotor , hemoglobinin oksijen tutma kapasitesini artırır ve kan damarlarında sert zincirler oluşturmasını engeller. Bu, kırmızı kan hücrelerinin normal şekillerini ve esnekliklerini korumalarına yardımcı olur. Ayrıca erken yıkım oranlarını azaltır ve ömürlerini uzatır 4 .
Ne kadar verimli? Adakveo Ve Oxbryta ?
Etkinliği Adakveo ( crizanlizumab ) Ve Oxbryta ( voxelotor ) klinik çalışmalarda incelenmiştir.
-
Adakveo klinik araştırma sonuçları
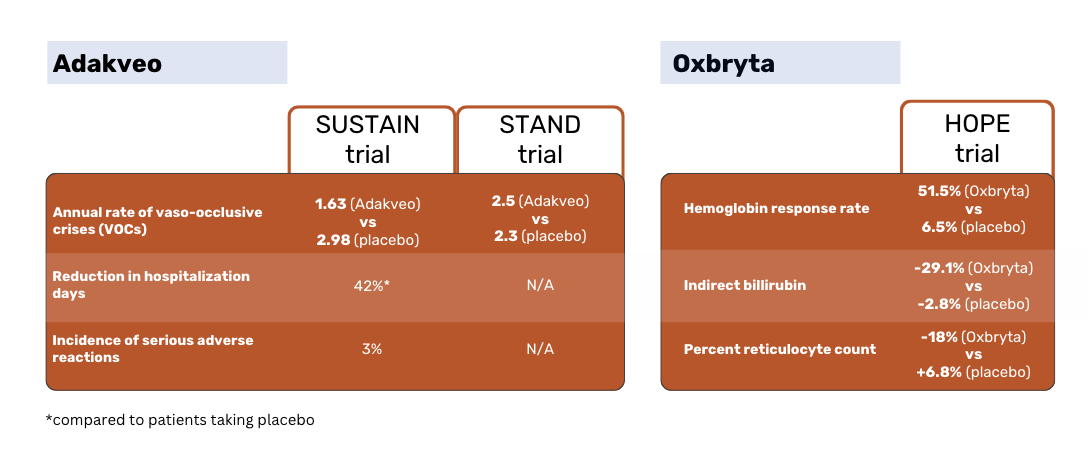
Adakveo FDA onayı ve AB'deki ilk pazarlama yetkisi, SUSTAIN klinik çalışmasının sonuçlarına dayanıyordu. Çalışma, Adakveo (hidroksiüre ile veya hidroksiüre olmadan) plaseboya karşı.
SUSTAIN çalışmasının sonuçlarına göre, Adakveo istatistiksel olarak anlamlı derecede daha düşük bir yıllık vazo-oklüzif kriz (VOC) medyan oranına sahipti - plasebo hastalarına kıyasla 1,63'e karşı 2,98. %36 Adakveo Deneydeki hastalarda 52 haftalık deneme süresi boyunca hiçbir VOC görülmezken, plasebo hastalarında bu oran %17 idi 1 .
Sonuçlar nelerdi? Adakveo STAND davası mı?
Küresel faz 3 STAND çalışması, tekrar karşılaştırdı Adakveo plaseboya karşı, hasta grupları arasında VOC oranında istatistiksel olarak anlamlı bir fark göstermede başarısız oldu. Adakveo Tedaviye başladıktan bir yıl sonra ortalama 2,5 ağrılı kriz geçirdiler - bu, plasebo grubunda bildirilen ortalama 2,3 krizden anlamlı derecede farklı değildi 3 .
STAND davasının ikna edici olmayan sonuçları Adakveo AB'de iptaline gerekçe oldu.
-
Oxbryta klinik araştırma sonuçları
HOPE davasında, Oxbryta plaseboya karşı test edildi. Etkinlik, başlangıç seviyesinden 24. haftaya kadar >1 g/dL'lik bir Hb artışı olarak tanımlanan hemoglobin (Hb) yanıt oranlarına dayanıyordu.
Oxbryta hastaların yanıt oranı %51,1 iken plasebo hastalarında bu oran %6,5'ti. Dolaylı bilirubin %29,1 oranında azaldı Oxbryta hastalarda, plasebo hastalarında %2,8'lik bir azalmaya kıyasla. Retikülosit sayısı yüzdesi %18 azaldı Oxbryta hastalarda %6,8 oranında artış görüldü ve plasebo hastalarında ise %6,8 oranında artış görüldü.
Paylaşılan verilerin gösterdiği gibi, iki ilaç arasında doğrudan bir karşılaştırma yapmak mümkün değildir, çünkü klinik deneylerinde farklı etkinlik kriterleri kullanılmıştır. Her iki tedavi de orak hücre hastalığına farklı şekilde yaklaştığı için, Oxbryta doğrudan bir ikamesi olmayacak Adakveo , daha ziyade doktorunuzun sizin için hazırlayacağı yeni tedavi planının bir parçasıdır.

Adakveo Karşı Oxbryta : Güvenlik ve yan etkiler
Reçete bilgilerine göre, bunlar ilacın en sık görülen yan etkileridir. Adakveo Ve Oxbryta :
Adakveo yan etkiler
- Mide bulantısı
- Eklem ağrısı
- Sırt ağrısı
- Mide ağrısı
- Ateş 1 .
SUSTAIN çalışması sırasında hastaların %3'ünde baş ağrısı, titreme, kusma, ishal, nefes darlığı veya hırıltı gibi semptomlarla karakterize infüzyonla ilişkili reaksiyonlar görüldü 1 .
Oxbryta yan etkiler
- Baş ağrısı
- İshal
- Mide ağrısı
- Mide bulantısı
- Döküntü
- Ateş 2 .
Klinik deney hastalarının %1'den azında döküntü, hafif nefes darlığı, hafif yüz şişmesi ve eozinofili (beyaz kan hücrelerinin sayısında artış) dahil olmak üzere ciddi aşırı duyarlılık reaksiyonları yaşandı 2 .
Adakveo Karşı Oxbryta : Fiyat karşılaştırması
Henüz onaylanmamış veya mevcut olmayan ilaçların fiyatlarına gelince, bunları yalnızca gösterge olarak almalısınız. Son fiyat, bulunduğunuz yere veya tedarikçiye bağlı olarak değişebilir.
Adakveo yıllık maliyetler
Önerilen dozaj Adakveo her 4 haftada bir vücut kütlesinin kg'ı başına 5 mg'dır. Bu, yılda 13 infüzyon anlamına gelir. 60 kg ağırlığındaki bir kişi için bu, 13 infüzyon x 300 mg gerektirir Adakveo veya ilacın 39 şişesi.
100 mg'lık bir flakon için yaklaşık 5.214 Avro'luk bir fiyatla, bir ilacın yıllık maliyeti Adakveo Tedavi masrafları yaklaşık 203.346 Avro'ya denk geliyor.
Oxbryta yıllık maliyetler
Önerilen dozaj Oxbryta Vücut ağırlığı 40 kg'ın üzerinde olan hastalar için 1.500 mg Oxbryta Günde bir kez, her biri 500 mg'lık 3 tablete eşdeğerdir.
90 x 500 mg'lık bir tablet paketi yaklaşık 40.365 Avro'ya mal olur ve yukarıda önerilen dozaja göre bir ay için yeterlidir. Bu nedenle, yıllık maliyet Oxbryta Tedavi masrafları 484.380 Avro'ya ulaşıyor 6 .
Neredeler? Adakveo Ve Oxbryta onaylı?
Adakveo ( crizanlizumab ) şu anda ABD, Kanada ve Avustralya dahil olmak üzere birçok ülkede onaylanmıştır 7,9,10 . AB'deki koşullu pazarlama yetkisi Mayıs 2023'te iptal edildi 3 .
Oxbryta ( voxelotor ) ABD, AB ve Kanada'da onaylanmıştır 4,8,9 . Ancak AB içinde, Oxbryta Henüz piyasada yaygın olarak bulunmuyor çünkü yetkilendirme ile pazara sunulma arasındaki süre ülkeden ülkeye önemli ölçüde farklılık gösterebiliyor.
mı Adakveo veya Oxbryta Ülkenizde artık onaylanmamış veya mevcut değil mi? Siz ve doktorunuz bu tedavilerin size fayda sağlayabileceği görüşündeyseniz, Medicine Access uzmanlarından oluşan ekibimizle iletişime geçin. Sizin için ilacı temin etmek üzere kişiselleştirilmiş bir fiyat teklifi verebiliriz.
Referanslar:
- REÇETELEME BİLGİLERİNİN ÖNEMLİ NOKTALARI . Novartis, Erişim tarihi 27 Eylül 2023.
- REÇETE BİLGİLERİNİN ÖNEMLİ NOKTALARI . Oxbryta , 27 Eylül 2023'te erişildi.
- Adakveo | Avrupa İlaç Ajansı . Avrupa İlaç Ajansı, Erişim tarihi 27 Eylül 2023.
- Oxbryta | Avrupa İlaç Ajansı . Avrupa İlaç Ajansı, Erişim tarihi 27 Eylül 2023.
- Adakveo ( crizanlizumab ) Online Satın Alın . Everyone.org , 27 Eylül 2023'te erişildi.
- Oxbryta ( voxelotor ) Çevrimiçi Satın Alın . Everyone.org , 27 Eylül 2023'te erişildi.
- Adakveo . Terapötik Ürünler İdaresi (TGA), Erişim tarihi 27 Eylül 2023.
- FDA, pediatrik hastalarda orak hücreli anemiyi tedavi etmek için ilacı onayladı . FDA, 17 Aralık 2021.
- 2019'da Onaylanan Yeni İlaçlar - Meds Entry Watch . Canada.ca, 10 Şubat 2021.
- FDA, orak hücreli aneminin ağrılı komplikasyonu olan hastaları tedavi etmek için ilk hedefli tedaviyi onayladı . FDA, 15 Kasım 2019.