Enhertu akciğer kanseri için: Nerede onaylandı ve nasıl alınır?
Son Güncelleme 15 Temmuz 2024
Ülkenizde onaylanmamış olsalar bile yeni ilaçlara yasal olarak erişebilirsiniz.
Nasıl olduğunu öğreninEnhertu (fam-trastuzumab deruxtecan-nxki) 2019 yılında FDA tarafından ilk kez onaylanmasından bu yana izlenmesi gereken kanser tedavilerinden biri olmuştur1.
Enhertu 'un yumurtalık kans eri ve kolorektal kanserdeki güvenlik ve etkinliği halen araştırılmakta olup, ilaç halihazırda çeşitli endikasyonlar için onaylanmıştır. HER2-pozitif meme kanseri, HER2-pozitif mide kanseri ve HER2-düşük meme kanseri dahil. FDA ayrıca HER2-mutant küçük hücreli dışı akciğer kanseri için Enhertu adresini onaylamıştır. Avrupa'daki CHMP de kısa süre önce AB 2 kapsamında aynısını yapmak için olumlu görüş bildirmiştir.
Birleşik Krallık'ta veya ABD ve AB dışında başka bir yerde akciğer kanseri hastasıysanız, muhtemelen Enhertu adresinin sizin için de ne zaman kullanılabilir olacağını merak ediyorsunuzdur.
İşte akciğer kanseri için Enhertu hakkında bilinmesi gereken her şey ve Birleşik Krallık'taki ve dünyanın geri kalanındaki hastaları nelerin beklediği.
Akciğer kanseri için Enhertu endikasyonu nedir?
Hedefe yönelik bir tedavi olarak Enhertu sadece HER2 mutasyonu olan kanserleri tedavi etmek için tasarlanmıştır. Bu nedenle, tedavi tüm NSCLC hastalarının yaklaşık %2'si için geçerlidir3.
Enhertu tümörlerinde aktive edici HER2 (ERBB2) mutasyonu olan ileri evre KHDAK'li yetişkin hastalarda monoterapi olarak endikedir. Enhertu daha önce sistemik tedavi almış ve kanseri vücudun diğer bölgelerine yayılmış ya da cerrahi olarak çıkarılamayan hastalara yöneliktir2.
Akciğer kanseri için Enhertu sitesinin başarı oranı nedir?
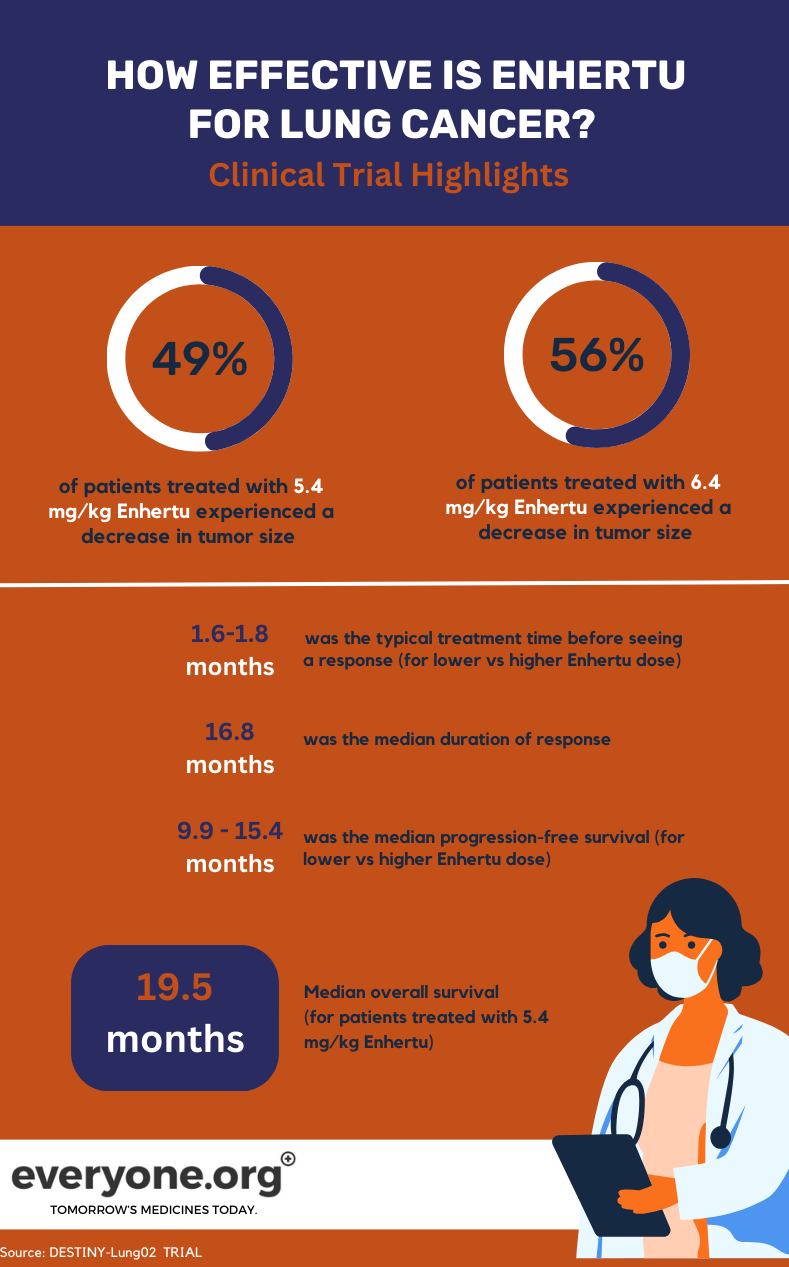
Devam etmekte olan DESTINY-Lung02 Faz II çalışması, HER2 mutasyonlu NSCLC tedavisinde Enhertu'un güvenliğini ve etkinliğini araştırmaktadır. Çalışmada iki Enhertu dozu (5.4 mg/kg ve 6.4 mg/kg) karşılaştırılmaktadır.
Akciğer kanseri hastaları için, DESTINY-Lung02 çalışmasından elde edilen önemli ön sonuçlar şunlardır:
- Düşük Enhertu dozla tedavi edilen hastaların %49'unda ve yüksek dozla tedavi edilenlerin %56'sında tümörler küçülmüştür.
- Düşük ve yüksek doz grubundaki hastaların sırasıyla %1 ve %4'ünde tümörler tamamen kaybolmuştur.
- Düşük Enhertu doz grubundaki hastalar için medyan yanıt süresi 16,8 ay olmuştur. Diğer gruptaki hastalar için DoR tahmin edilebilir değil olarak rapor edilmiştir.
- İlk tedavi yanıtını gözlemlemek için gereken ortanca süre, düşük ve yüksek doz grubunda sırasıyla 1,8 ay ve 1,6 ay olmuştur.
- Ortanca progresyonsuz sağkalım 5,4 mg/kg'da 9,9 ay ve 6,4 mg/kg'da 15,4 ay olmuştur4.
Enhertu hastaları için medyan sağkalım ne kadardı?
Klinik çalışmada daha düşük Enhertu dozunu alan hastalar için medyan genel sağkalım (OS) 19,5 ay olmuştur. Yüksek doz grubu 4 için OS tahmin edilemez olarak rapor edilmiştir.
Enhertu 'un akciğerler üzerindeki yan etkileri nelerdir?
Enhertu hastalarında bazı ciddi, yaşamı tehdit eden veya ölümcül interstisyel akciğer hastalığı (ILD) vakaları bildirilmiştir. Orta derecede böbrek yetmezliği olan hastalar daha yüksek risk altında olabilirler6.
DESTINY-Lung02 çalışmasında, düşük doz grubundaki hastaların %12,9'unda ve yüksek doz grubundaki hastaların %28'inde İAH bildirilmiştir. Bu vakaların çoğu şiddetli değildi. Her iki hasta grubunda da hastaların %2'sinde Grade 3 veya daha yüksek İAH bildirilmiştir.
Enhertu'nin akciğer kanseri için güvenlik profili diğer endikasyonlardaki performansına benzerdir. Daha düşük advers etki insidansına (%38,6'ya karşı %58) dayanarak, 5,4 mg/kg dozunun NSCLC hastaları için en uygun tedavi olduğu düşünülmektedir4.

Enhertu akciğer kanseri için nerede onaylanmıştır?
Şu anda Enhertu , tümörlerinde aktive edici HER2 (ERBB2) mutasyonları olan rezeke edilemeyen veya metastatik KHDAK'li yetişkin hastaların tedavisi için ABD, AB, İsrail ve Japonya'da onaylanmıştır4.
Enhertu Birleşik Krallık'ta akciğer kanseri için onaylandı mı?
Temmuz 2024 itibariyle henüz değil. NICE tarafından Mart 2024'te yayınlanan nihai taslak kılavuzda, Enhertu 'un uygun maliyetli bir fiyat elde edilene kadar NHS'de yer almayacağı duyurulmuştur. Bu arada, ne yazık ki, Enhertu Birleşik Krallık'ta akciğer kanseri için mevcut değildir7.
Henüz onaylanmamışsa doktorum akciğer kanseri için Enhertu adresini reçete edebilir mi?
Kısa cevap evet.
Enhertu HER2 mutasyonlu NSCLC tedavisi için birçok ülkede onaylanmıştır. Buna dayanarak, ülkenizde henüz onaylanmamış olsa bile doktorunuz ilacı bu endikasyon için reçete etme yetkisine sahiptir.
Bir doktor bir ilacı (henüz) onaylanmamış bir hastalığı tedavi etmek için reçete ettiğinde, buna endikasyon dışı kullanım denir. Yerel düzenlemelere ve bulunabilirliğe bağlı olarak, endikasyon dışı kullanım reçetesinin bazı ülkelerde doldurulması zor olabilir. Ancak, Adlandırılmış Hasta İthalatı yönetmeliğini kullanarak doldurmak her zaman mümkündür.
Doktorunuz akciğer kanserinizin tedavisi için Enhertu adresini reçete etmeye karar verdi mi? www.everyone.org adresindeki ekibimiz ilaca erişmenize yardımcı olabilir. Hastanın ülkesinde onaylanmamış veya bulunmayan reçeteli ilaçların tedariki ve teslimatı konusunda uzmanız. Size yardımcı olabilmemiz için bizimle iletişime geçin.
Referanslar:
- Stewart, Judith. Enhertu (fam-trastuzumab deruxtecan-nxki) FDA Onay Geçmişi. Drugs.com, 15 Ağustos 2022.
- Enhertu. Avrupa İlaç Ajansı, Erişim tarihi 06 Kasım 2023.
- HER2 ve Akciğer Kanseri. Amerikan Akciğer Derneği, Erişim tarihi 6 Kasım 2023.
- Enhertu DESTINY-Lung02 Faz II çalışmasında daha önce tedavi edilmiş HER2-mutant ileri evre akciğer kanserinde güçlü ve kalıcı tümör yanıtları gösterdi. AstraZeneca, 11 Eylül 2023.
- Proje bilgileri | 1 veya daha fazla tedaviden sonra HER2 mutasyonlu rezeke edilemeyen veya metastatik skuamöz olmayan küçük hücreli dışı akciğer kanserinin tedavisi için trastuzumab deruxtecan [ID3934] | Kılavuz. NICE, Erişim tarihi 6 Kasım 2023.
- USPI-DB-04 CDX Güncellemesi FINAL. Daiichi Sankyo, Erişim tarihi 6 Kasım 2023.
- UK NICE, meme kanseri için Daiichi Sankyo'un Enhertu adresini reddetti, Pharmaceutical Technology, Erişim tarihi 15 Temmuz 2024.